
【研究概要】
生物にとって,その遺伝情報を担うゲノムDNAを細胞から細胞へ、親から子へと正確に伝え維持することは最も基本的な生物学的機能であるが、ゲノムDNAやその前駆体であるヌクレオチドは、酸素呼吸の過程で必然的に発生する活性酸素や生体防御のために生体が能動的に産生する活性酸素によって酸化される危険に常に曝されている。活性酸素に曝されたDNAやヌクレオチドは様々な酸化的化学修飾を受けるが、このような酸化損傷は修復、除去されないと突然変異を引き起こすことで細胞のがん化の原因となり、あるいは細胞死を引き起こすことでパーキンソン病やアルツハイマー病などの神経変性疾患の原因になると考えられるが、その詳細な分子機序は不明である。
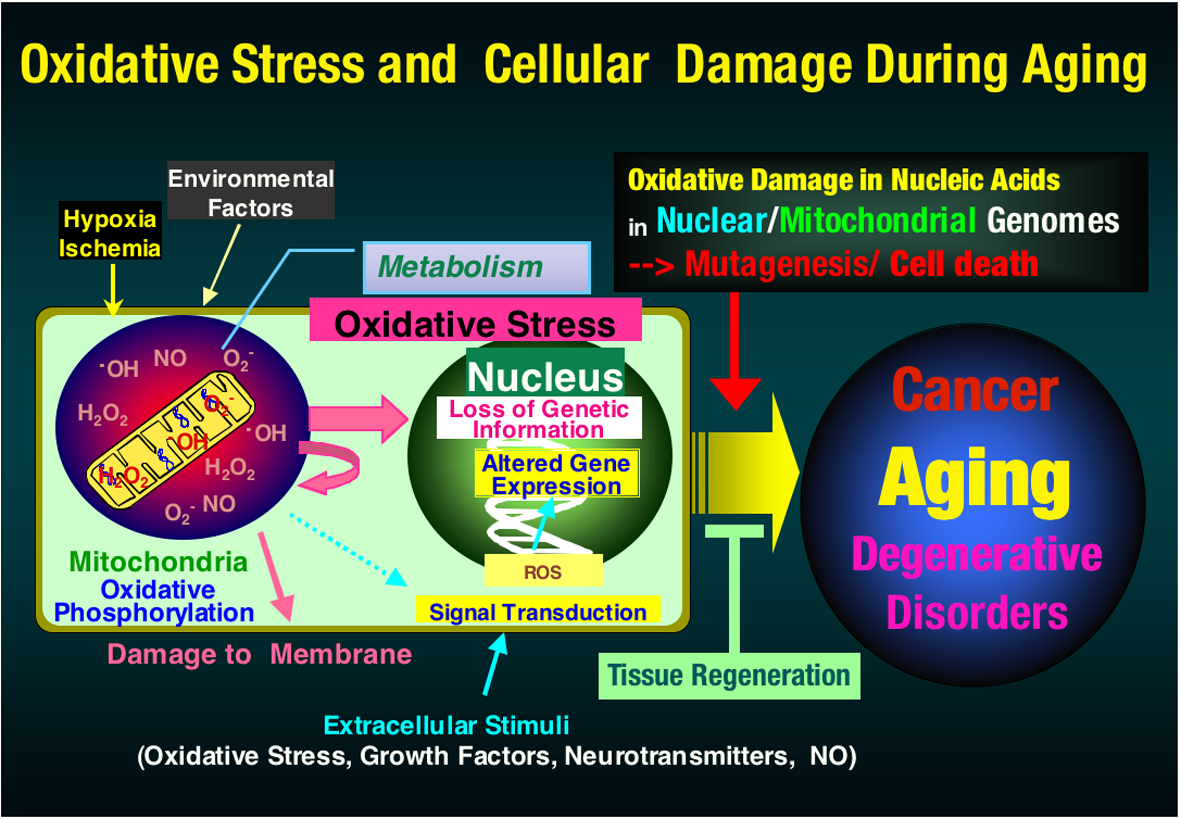
我々は、生体がその代謝やシグナル伝達、生体防御反応、環境応答など種々の過程で産生する活性酸素による増殖性細胞の障害として「突然変異と発がん」に、さらに非増殖性細胞の障害として「細胞死と脳・神経変性」に注目して「活性酸素によるゲノム障害とその防御機構」の解明を進めている。
8-オキソグアニン(8-oxoG)はほ乳動物の自然突然変異と発がんの原因であるが、MTH1(8-oxo-dGTPase)とOGG1(8-oxoG DNA glycosylase)はそのゲノム蓄積を抑制し、MUTYH(adenine DNA glycosylase)はゲノムに蓄積した8-oxoGに誤って取り込まれたアデニンを除去することで、突然変異と発がんを抑制する。8-oxoGは細胞死も誘導するが、MTH1とOGG1はそのゲノム蓄積を回避することで細胞死を抑制する。一方、MUTYHは8-oxoGに対合したアデニンの除去修復を介して細胞死を誘導する。そのため、酸化ストレスに曝された神経組織では、MUTYHに依存して神経細胞死とミクログリオーシスが誘導され、神経変性が進行する。
ゲノムへの8-oxoGの蓄積を防ぐMTH1と8-oxoG DNAグリコシラーゼ(OGG1)の両者を欠損するTO-DKOマウスと野生型マウスの詳細な解析から、MTH1とOGG1が欠損すると野生型マウスと比べて雌マウスにおいてのみ海馬と側脳室下帯の神経前駆細胞の核ゲノムに8-oxoGが蓄積し、新生神経細胞がアポトーシスに陥ることを発見した。側脳室下帯で生まれた新生神経細胞は脳内を移動して自発運動を抑制する脳の特定部位(大カレハ島)へ供給されるが、TO-DKO雌マウスではこの大カレハ島が顕著に萎縮し、自発運動量が高いレベルのまま維持されていた。また、TO-DKO雌マウスでは海馬歯状回も萎縮し、軽度の認知機能障害が認められた。一方、ヒトMTH1を雌マウスで高発現させると、8-oxoGの蓄積が抑制されて活動量が低下することから、ヌクレオチドプール中のdGTPが酸化されて生じた8-oxo-dGTPが神経前駆細胞のゲノムに取り込まれ、アポトーシスを引き起こすことが明らかになった。これらの結果は、雌マウスの神経前駆細胞にはそのヌクレオチドプール中のdGTPが酸化されやすい細胞内環境、すなわち雌特異的な活性酸素生成系が存在することを示している。このような活性酸素生成系の存在が、女性が男性よりもアルツハイマー病を発症しやすい理由かもしれない。しかし、そのような環境下でもMTH1とOGG1が神経前駆細胞のゲノムに8-oxoGが高度に蓄積するのを抑えることで正常な脳機能が維持されていることが明らかになった。
アルツハイマー病(AD)患者の海馬ではインスリン産生低下によりグルコース代謝障害とミトコンドリア機能障害に陥るため、酸化ストレスの亢進が神経変性に関与することが死後脳のトランスクリプトーム解析から明らかになった(久山町研究)。ADモデルマウスにヒトミトコンドリア転写因子hTFAMを発現させると、ミトコンドリア機能の維持とTransthyretinの発現誘導により神経変性が抑制され、認知機能が改善される。AD大脳皮質では炎症反応や免疫疾患に関連する遺伝子の発現が顕著に増加しており、アミロイドーシスが脳内炎症応答を引き起こすことが示唆された。
AD患者の病態の進行に伴って脳ゲノムには8-oxoGが高度に蓄積することが知られている。我々は、MTH1とOGG1の発現レベルが孤発性AD患者の脳で顕著に低下していることを見出し、MTH1とOGG1の機能低下がAD患者脳における8-oxoGの蓄積を引き起こし、AD病態の進行に関与する可能性を検討した。3xTg-ADモデルマウスにMth1とOgg1遺伝子の二重欠損を導入した新しいADマウスモデル(ADH•TO-DKH)を樹立し、解析したところ、ADH•TO-DKHマウス脳では、4〜5ヶ月齢で核ゲノムへの8-oxoG蓄積が3xTg-ADマウス脳に比べて顕著に増加し、程度は低いもののミトコンドリアゲノムへの蓄積も増加していた。4〜5ヶ月齢の3xTg-ADマウスでは認知機能障害やAD病理像はまだ認められないが、ADH•TO-DKHマウスは顕著な認知機能障害を示し、海馬と大脳皮質においてミクログリアの活性化と神経細胞の脱落を認めた。ADH•TO-DKHマウスにミノサイクリンを投与しミクログリアの活性化を阻害すると、ミクログリアの核ゲノムにおける8-oxoGの蓄積が顕著に低下し、ミクログリオーシスの軽減とともに神経細胞脱落も抑えられた。海馬における遺伝子発現のプロファイリングから、MTH1とOGG1は、トランスサイレチンをはじめとするAβとTauに起因するAD病態の進行を抑えるさまざまな遺伝子の発現誘導を介して、AD病態の進行を効率的に抑制することが明らかになった。我々の発見は、脳ゲノムにおける8-oxoGの蓄積を抑えることでADの発症や進展をコントロールできることを示しており、新たな治療法の開発が期待される。
イノシン三リン酸ピロホスファターゼ(ITPA)は、ATPの酸化的脱アミノ化で生じるイノシン三リン酸(ITP)およびその他の脱アミノ化プリンヌクレオシド三リン酸をヌクレオシド一リン酸に加水分解する。近年、ヒトではITPA欠損変異がてんかん発作、小頭症、および発達遅滞を伴う重度の脳症を引き起こすことが報告されてきた。我々は、神経幹細胞特異的コンディショナルItpaノックアウト(Itpa-cKO)マウスを樹立し、ITPA欠損が神経系に及ぼす影響を解析した。Itpa-cKOマウスは成長遅延を示し、出生後3週間以内に死亡した。Itpa-cKOマウスでは小頭症は観察されなかったが、雌のみで副腎形成不全が観察された。我々は、Itpa-cKOマウスが尾懸垂時に四肢を前面で交差させる表現形を示し、さらに自発的なてんかん発作と聴原性てんかん発作を示すことを見出した。また、脳スライスを用いた嗅内皮質神経細胞からの全細胞パッチクランプ記録により、コントロールマウスと比較してItpa-cKOマウスにおける静止膜電位の上昇、活動電位発火の増加、自発的ミニチュア興奮性シナプス後電流の頻度と振幅の増加、そしてミニチュア抑制性シナプス後電流の頻度の増加を明らかにした。神経細胞内に蓄積したITPまたはその代謝物(環状イノシン一リン酸など)、あるいはイノシンを高度に蓄積したRNAが、神経細胞の脱分極および過興奮を引き起こし、てんかん発作を含むITPA欠損マウスの表現型を誘発する可能性が示唆される。
【Major Publications】
1. Anene-Nzelu CG, Li PY, Luu TDA, Ng SL, Tiang Z, Pan B, Tan WLW, Ackers-Johnson M, Chen CK, Lim YP, Qin RWM, Chua WW, Yi LX, Foo RS, Nakabeppu Y. 8-Oxoguanine DNA Glycosylase (OGG1) Deficiency Exacerbates Doxorubicin-Induced Cardiac Dysfunction. Oxid Med Cell Longev 2022: 9180267, 2022.
2. Mizuno, Y., Abolhassani, N., Mazzei, G., Sakumi, K., Saito, T., Saido, T.C., Ninomiya, T., Iwaki, T., Yamasaki, R., Kira, J.-i., and Nakabeppu, Y. MUTYH Actively Contributes to Microglial Activation and Impaired Neurogenesis in the Pathogenesis of Alzheimer's Disease. Oxid Med Cell Longev 2021, 8635088, 2021.
3. Mizuno, Y., Abolhassani, N., Mazzei, G., Saito, T., Saido, T.C., Yamasaki, R., Kira, J.I., and Nakabeppu, Y. Deficiency of MTH1 and/or OGG1 increases the accumulation of 8-oxoguanine in the brain of the App(NL-G-F/NL-G-F) knock-in mouse model of Alzheimer's disease, accompanied by accelerated microgliosis and reduced anxiety-like behavior. Neurosci Res 177: 118-134, 2021.
4. Mazzei, G., Ikegami, R., Abolhassani, N., Haruyama, N., Sakumi, K., Saito, T., Saido, T.C., and Nakabeppu, Y. A high-fat diet exacerbates the Alzheimer's disease pathology in the hippocampus of the App(NL-F/NL-F) knock-in mouse model. Aging Cell 20: e13429, 2021.
5. Nakamura, T., Okabe, K., Hirayama, S., Chirifu, M., Ikemizu, S., Morioka, H., Nakabeppu, Y., and Yamagata, Y. Structure of the mammalian adenine DNA glycosylase MUTYH: insights into the base excision repair pathway and cancer. Nucleic Acids Res 49: 7154-7163, 2021.
6. MTH1 and OGG1 maintain a low level of 8-oxoguanine in Alzheimer's brain, and prevent the progression of Alzheimer's pathogenesis. Oka S, Leon J, Sakumi K, Abolhassani N, Sheng Z, Tsuchimoto D, LaFerla FM, Nakabeppu Y. Sci Rep 11:5819, 2021.
7. Neural stem cell-specific ITPA deficiency causes neural depolarization and epilepsy. Koga Y, Tsuchimoto D, Hayashi Y, Abolhassani N, Yoneshima Y, Sakumi K, Nakanishi H, Toyokuni S, Nakabeppu Y. JCI Insight 5:e140229, 2020.
8. 8-Oxoguanine accumulation in aged female brain impairs neurogenesis in the dentate gyrus and major island of Calleja, causing sexually dimorphic phenotypes. Haruyama, N., Sakumi, K., Katogi, A., Tsuchimoto, D., De Luca, G., Bignami, M., and Nakabeppu, Y. Prog Neurobiol 180:101613, 2019.
9. Origins of Brain Insulin and Its Function. In Diabetes Mellitus, A rist factor for Alzheimmer's disease. Nakabeppu, Y. (Nakabeppu, Y., and Ninomiya, T., eds), Springer, Advances in Experimental Medicine and Biology 1128: 1-11,2019.
10. Molecular Pathophysiology of Insulin Depletion, Mitochondrial Dysfunction, and Oxidative Stress in Alzheimer's Disease Brain. In Diabetes Mellitus, A risk factor for Alzheimer's disease. Nakabeppu, Y. (Nakabeppu, Y., and Ninomiya, T., eds), Springer, Advances in Experimental Medicine and Biology 1128: 27-44, 2019.
11. MTH1 as a nucleotide pool sanitizing enzyme: Friend or foe? Nakabeppu, Y., Ohta, E., and Abolhassani, N. Free Radic Biol Med 107: 151-158, 2017.
12. Neurodegeneration Caused by Accumulation of an Oxidized Base Lesion, 8-oxoguanine, in Nuclear and Mitochondrial DNA: From Animal Models to Human Diseases. In The Base Excision Repair Pathway – Molecular Mechanisms and Role in Disease Development and Therapeutic Design. Nakabeppu, Y. (Wilson III, D. M., ed), World Scientific, 523-556, 2017.
13. Comparative profiling of cortical gene expression in Alzheimer's disease patients and mouse models demonstrates a link between amyloidosis and neuroinflammation. Castillo, E., Leon, J., Mazzei, G., Abolhassani, N., Haruyama, N., Saito, T., Saido, T., Hokama, M., Iwaki, T., Ohara, T., Ninomiya, T., Kiyohara, Y., Sakumi, K., LaFerla, F. M., and Nakabeppu, Y. Sci Rep 7: 17762, 2017.
14. 2-Oxoadenosine induces cytotoxicity through intracellular accumulation of 2-oxo-ATP and depletion of ATP but not via the p38 MAPK pathway. Asada, S., Ohta, E., Akimoto, Y., Abolhassani, N., Tsuchimoto, D., and Nakabeppu, Y. Sci Rep 7: 6528, 2017.
15. Molecular pathophysiology of impaired glucose metabolism, mitochondrial dysfunction, and oxidative DNA damage in Alzheimer's disease brain. Abolhassani, N., Leon, J., Sheng, Z., Oka, S., Hamasaki, H., Iwaki, T., and Nakabeppu, Y. Mech Ageing Dev 161: 95-104, 2017.
16. Deoxyinosine triphosphate induces MLH1/PMS2- and p53-dependent cell growth arrest and DNA instability in mammalian cells. Yoneshima, Y., Abolhassani, N., Iyama, T., Sakumi, K., Shiomi, N., Mori, M., Shiomi, T., Noda, T., Tsuchimoto, D., and Nakabeppu, Y. Sci Rep 6: 32849, 2016.
17. PKCeta deficiency improves lipid metabolism and atherosclerosis in apolipoprotein E-deficient mice. Torisu, K., Zhang, X., Nonaka, M., Kaji, T., Tsuchimoto, D., Kajitani, K., Sakumi, K., Torisu, T., Chida, K., Sueishi, K., Kubo, M., Hata, J., Kitazono, T., Kiyohara, Y., and Nakabeppu, Y. Genes Cells 21: 1030-1048, 2016.
18. Deficiency of base excision repair enzyme NEIL3 drives increased predisposition to autoimmunity. Massaad, M. J., Zhou, J., Tsuchimoto, D., Chou, J., Jabara, H., Janssen, E., Glauzy, S., Olson, B. G., Morbach, H., Ohsumi, T. K., Schmitz, K., Kyriacos, M., Kane, J., Torisu, K., Nakabeppu, Y., Notarangelo, L. D., Chouery, E., Megarbane, A., Kang, P. B., Al-Idrissi, E., Aldhekri, H., Meffre, E., Mizui, M., Tsokos, G. C., Manis, J. P., Al-Herz, W., Wallace, S. S., and Geha, R. S. J Clin Invest 126: 4219-4236, 2016.
19. 8-Oxoguanine accumulation in mitochondrial DNA causes mitochondrial dysfunction and impairs neuritogenesis in cultured adult mouse cortical neurons under oxidative conditions. Leon, J., Sakumi, K., Castillo, E., Sheng, Z., Oka, S., and Nakabeppu, Y. Sci Rep 6: 22086, 2016.
20. Galectin-1 deficiency improves axonal swelling of motor neurones in SOD1(G93A) transgenic mice. Kobayakawa, Y., Sakumi, K., Kajitani, K., Kadoya, T., Horie, H., Kira, J., and Nakabeppu, Y. Neuropathol Appl Neurobiol 41: 227-244, 2015.
21. Altered Expression of Diabetes-Related Genes in Alzheimer's Disease Brains: The Hisayama Study. Hokama M, Oka S, Leon J, Ninomiya T, Honda H, Sasaki K, Iwaki T, Ohara T, Sasaki T, LaFerla FM, Kiyohara Y, Nakabeppu Y. Cereb Cortex 24: 2476-2488. 2014.
22. MUTYH, an adenine DNA glycosylase, mediates p53 tumor suppression via PARP-dependent cell death. Oka S, Leon J, Tsuchimoto D, Sakumi K, Nakabeppu Y. Oncogenesis 3: e121, 2014.
23. Fosb gene products contribute to excitotoxic microglial activation by regulating the expression of complement C5a receptors in microglia. Nomaru H, Sakumi K, Katogi A, Ohnishi YN, Kajitani K, Tsuchimoto D, Nestler EJ, Nakabeppu Y. Glia 62: 1284-1298, 2014.
24. fosB-Null Mice Display Impaired Adult Hippocampal Neurogenesis and Spontaneous Epilepsy with Depressive Behavior. Yutsudo N, Kamada T, Kajitani K, Nomaru H, Katogi A, Ohnishi YH, Ohnishi YN, Takase K, Sakumi K, Shigeto H, Nakabeppu Y. Neuropsychopharmacology 38: 895-906, 2013.
25. 8-Oxoguanine causes neurodegeneration during MUTYH-mediated DNA base excision repair. Sheng Z, Oka S, Tsuchimoto D, Abolhassani N, Nomaru H, Sakumi K, Yamada H, Nakabeppu Y. J Clin Invest 122: 4344-4361. 2012.
26. MutT homolog-1 attenuates oxidative DNA damage and delays photoreceptor cell death in inherited retinal degeneration. Murakami Y, Ikeda Y, Yoshida N, Notomi S, Hisatomi T, Oka S, De Luca G, Yonemitsu Y, Bignami M, Nakabeppu Y, Ishibashi T. Am J Pathol 181: 1378-1386, 2012.
27. FosB is essential for the enhancement of stress tolerance and antagonizes locomotor sensitization by ΔFosB. Ohnishi YN, Ohnishi YH, Hokama M, Nomaru H, Yamazaki K, Tominaga Y, Sakumi K, Nestler EJ, Nakabeppu Y. Biol Psychiatry 70: 487-495, 2011.
28. NUDT16 is a (deoxy)inosine diphosphatase, and its deficiency induces accumulation of single-strand breaks in nuclear DNA and growth arrest. Iyama T, Abolhassani N, Tsuchimoto D, Nonaka M, Nakabeppu Y. Nucleic Acids Res 38: 4834-43, 2010.
29. NUDT16 and ITPA play a dual protective role in maintaining chromosome stability and cell growth by eliminating dIDP/IDP and dITP/ITP from nucleotide pools in mammals. Abolhassani N, Iyama T, Tsuchimoto D, Sakumi K, Ohno M, Behmanesh M, Nakabeppu Y. Nucleic Acids Res 38: 2891-903, 2010.
30. ITPase-deficient mice show growth retardation and die before weaning. Behmanesh M, Sakumi K, Abolhassani N, Toyokuni S, Oka S, Ohnishi YN, Tsuchimoto D, Nakabeppu Y. Cell Death Differ 16: 1315-4322, 2009.
26. Two distinct pathways of cell death triggered by oxidative damage to nuclear and mitochondrial DNAs. Oka S, Ohno M, Tsuchimoto D, Sakumi K, Furuichi M, Nakabeppu Y. EMBO J 27: 421-432, 2008.
31. Oxidation of mitochondrial deoxynucleotide pools by exposure to sodium nitroprusside induces cell death. Ichikawa J, Tsuchimoto D, Oka S, Ohno M, Furuichi M, Sakumi K, Nakabeppu Y. DNA Repair 7: 418-30, 2008.
32. A genome-wide distribution of 8-oxoguanine correlates with the preferred regions for recombination and single nucleotide polymorphism in the human genome. Ohno M, Miura T, Furuichi M, Tominaga Y, Tsuchimoto D, Sakumi K, Nakabeppu Y. Genome Res 16: 567-75, 2006.
33. MTH1, an oxidized purine nucleoside triphosphatase, protects the dopamine neurons from oxidative damage in nucleic acids caused by 1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine. Yamaguchi H, Kajitani K, Dan Y, Furuichi M, Ohno M, Sakumi K, Kang D, Nakabeppu Y. Cell Death Differ 13: 551-63, 2006.
34. MTH1, an oxidized purine nucleoside triphosphatase, suppresses the accumulation of oxidative damage of nucleic acids in the hippocampal microglia during kainate-induced excitotoxicity. Kajitani K, Yamaguchi H, Dan Y, Furuichi M, Kang D, Nakabeppu Y. J Neurosci 26: 1688-1698, 2006.
35. Up-regulation of hMUTYH, a DNA repair enzyme, in the mitochondria of substantia nigra in Parkinson's disease. Arai T, Fukae J, Hatano T, Kubo S, Ohtsubo T, Nakabeppu Y, Mori H, Mizuno Y, Hattori N. Acta Neuropathol 112: 139-45, 2006.
36. Growth retardation and dyslymphopoiesis accompanied by G2/M arrest in APEX2-null mice. Ide Y, Tsuchimoto D, Tominaga Y, Nakashima M, Watanabe T, Sakumi K, Ohno M, Nakabeppu Y. Blood 104: 4097-4103, 2004.
37. An oxidized purine nucleoside triphosphatase, MTH1, suppresses cell death caused by oxidative stress. Yoshimura D, Sakumi K, Ohno M, Sakai Y, Furuichi M, Iwai S, Nakabeppu Y. J Biol Chem 278: 37965-37973, 2003.
38. A molecular basis for the selective recognition of 2-hydroxy-dATP and 8-oxo-dGTP by human MTH1. Sakai Y, Furuichi M, Takahashi M, Mishima M, Iwai S, Shirakawa M, Nakabeppu Y. J Biol Chem 277:8579-8587, 2002.
39. Impairment of mitochondrial DNA repair enzymes against accumulation of 8-oxo-guanine in the spinal motor neurons of amyotrophic lateral sclerosis. Kikuchi H, Furuta A, Nishioka K, Suzuki SO, Nakabeppu Y, Iwaki T. Acta Neuropathol 103: 408-14, 2002.
40. Expression of 8-oxoguanine DNA glycosylase is reduced and associated with neurofibrillary tangles in Alzheimer's disease brain. Iida T, Furuta A, Nishioka K, Nakabeppu Y, Iwaki T. Acta Neuropathologica 103: 20-25, 2002.
41. Expression of hMTH1 in the hippocampi of control and Alzheimer's disease. Furuta A, Iida T, Nakabeppu Y, Iwaki T. Neuroreport 12: 2895-9, 2001.
42. Accumulation of 8-oxo-2'-deoxyguanosine and increased expression of hMTH1 protein in brain tumors. Iida T, Furuta A, Kawashima M, Nishida J, Nakabeppu Y, Iwaki T. Neuro Oncol 3: 73-81, 2001.
43. Increased 8-oxo-dGTPase in the mitochondria of substantia nigral neurons in Parkinson's disease.Shimura-Miura H, Hattori N, Kang D, Miyako K, Nakabeppu Y, Mizuno Y. Ann Neurol 46: 920-4, 1999.